HSC 2022 Chemistry Assignment Answer: Directorate of Secondary and Higher Secondary Education is published the Inter 1st Year HSC Chemistry 1st and 2nd Paper Assignment Answer 2022 in a pdf file on dshe.gov.bd.
Directorate of Secondary and Higher Secondary Education just published the 12th Week Assignment Question for the Chemistry Subject on 15th February 2022. Previously, DSHE was published the 9th Week Assignment Question on 5th February 2022.
Students need to submit the chemistry Assignment Answer to college within the timeframe.
Let’s Dive it in:
HSC 2022 Chemistry Assignment Answer
The National Curriculum and Textbook Board released the short syllabus for Chemistry Subjects, which is part of the Science Group, earlier this year (back in January 2022), and it is available online.
Therefore, DSHE will publish the assignments for this subject in accordance with this short syllabus.
DSHE Stated That Ten assignments are required for chemistry subjects from the students. As stated in the notice, the Directorate of Secondary and Higher Education will distribute Five Assignments for the first Paper and five Assignments for the second Paper.
Because of COVID-19, Students now have to participate in the Assignment Work worth 50 marks for the HSC Exam 2022. And the other 50 Marks is for MCQ Test will hold in June 2022
Read Also- HSC Higher Math Assignment Answer 2022
Since it now counts toward the HSC Exam 2022 grade point average, students must complete Assignment solutions as soon as possible after receiving the assignment question.
Following the Assignment Grid published by the Directorate of Secondary and Higher Education (DSHE), it has been announced that Science Group students will be assigned HSC Chemistry assignments for the HSC Exam in 2022, which will be administered in the following weeks:
6th Week 9th WeekDSHE is published the 12th Week HSC Chemistry Assignment Question for First Paper on dshe.gov.bd.
HSC Chemistry 1st Paper Assignment Answer 2022
It is now possible to download the HSC Exam 2022 First Paper Assignment question for Chemistry Subjects on the Directorate of Secondary and Higher Secondary Education (dshe.gov.bd). The question is available for the 1st Paper only for the 6th Week.
DUE to the COVID-19 Corona Virus Outbreak, The National Curriculum and Textbook Board (NCTB) has limited the chapter of the Chemistry 1st Paper syllabus for the exam year of HSC 2022, which will be administered in November 2021.
As a result, the number of chapters has been reduced to make the Syllabus more manageable for students and accommodate the limited time available for the HSC Exam 2021 in Bangladesh. There are now only Four chapters in the Syllabus of Chemistry 1st Paper Subject. As a result, only questions from these four chapters will be included in the Weekly Assignment Question. These Four Chapters are: Second (গুণগত রসায়ন), Third (মৌলের পর্যায়বৃত্ত ধর্ম ও রসায়ন), Fourth (রাসায়নিক পরিবর্তন), Fifth (কর্মমুখী রসায়ন).
DSHE will assign the HSC Chemistry 1st Paper Assignment in the following weeks:
12th Week HSC Chemistry Assignment Answer 2022
The directorate of Secondary and Higher Secondary Education just published the HSC Chemistry 12th Week Assignment Question paper. The question paper is available in both image or pdf file.
Students just simply follow this article to view the question for 12th Week and a sample assignment answer.
Class: HSC 1st Year
Subject: Chemistry 1st Paper
Group: Science
Week: 12th Week
Assignment Work: দ্রবণের আয়নিক গুনফল এবং দ্রাব্যতা গুণফলের প্রয়োগ নিরুপন কর।

Assignment Answer: Will Publish Soon
HSC Chemistry Assignment 2022 7th Week Answer
The 7th Week Week Chemistry 1st Paper Assignment Question is from the Fourth Chapter ( রাসায়নিক পরিবর্তন ). It has been released by the Directorate of Secondary and Higher Secondary Education.
Dshe.gov.bd provide students with online materials such as the assignment question, Learning Objectives, instructions on how to write the assignment answer, and rubrics or evaluation criteria.
Students can also access these resources through this website. They just need to follow this article:
Class: HSC 1st Year
Subject: Chemistry 1st Paper
Group: Science
Week: 7th Week
Assignment Work: অর্বিটালের সংকলন ও রাসায়নিক বন্ধন
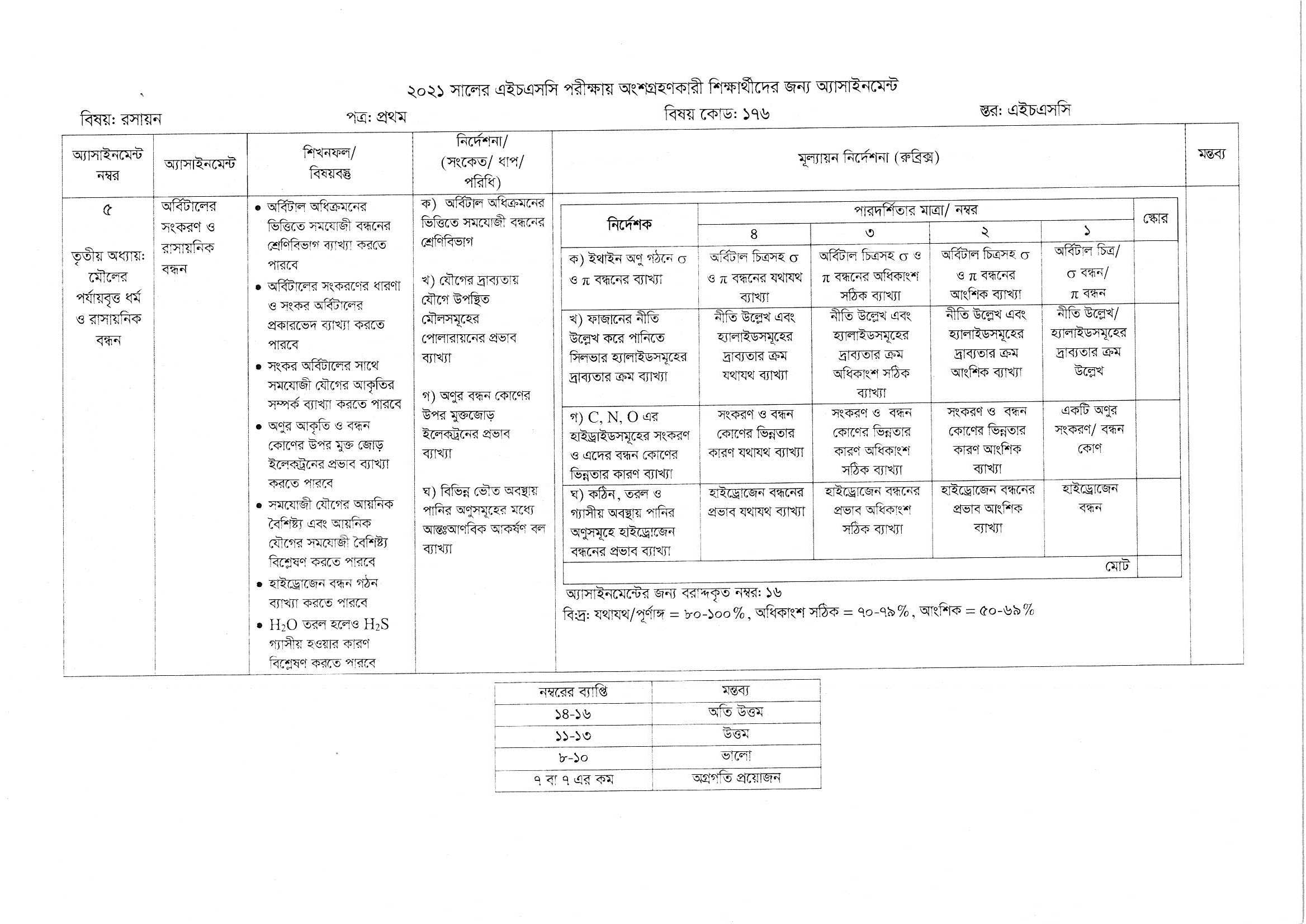
Assignment Answer:



HSC Chemistry 4th Week Assignment Answer 2021
Directorate of Secondary and Higher Secondary Education is published the 4th Week Week Chemistry 1st Paper Assignment Question from the Third Chapter.
Online resources such as the assignment question, Learning Objectives, instructions on how to write the assignment answer, and rubrics or assessment criteria are all available to students on dshe.gov.bd as well as on this website.
Class: HSC 1st Year
Subject: Chemistry 1st Paper
Group: Science
Week: 4th Week
Assignment Work: মৌলসমূহের শ্রেণিবিভাগ ও পর্যায়বৃত্ত ধর্ম
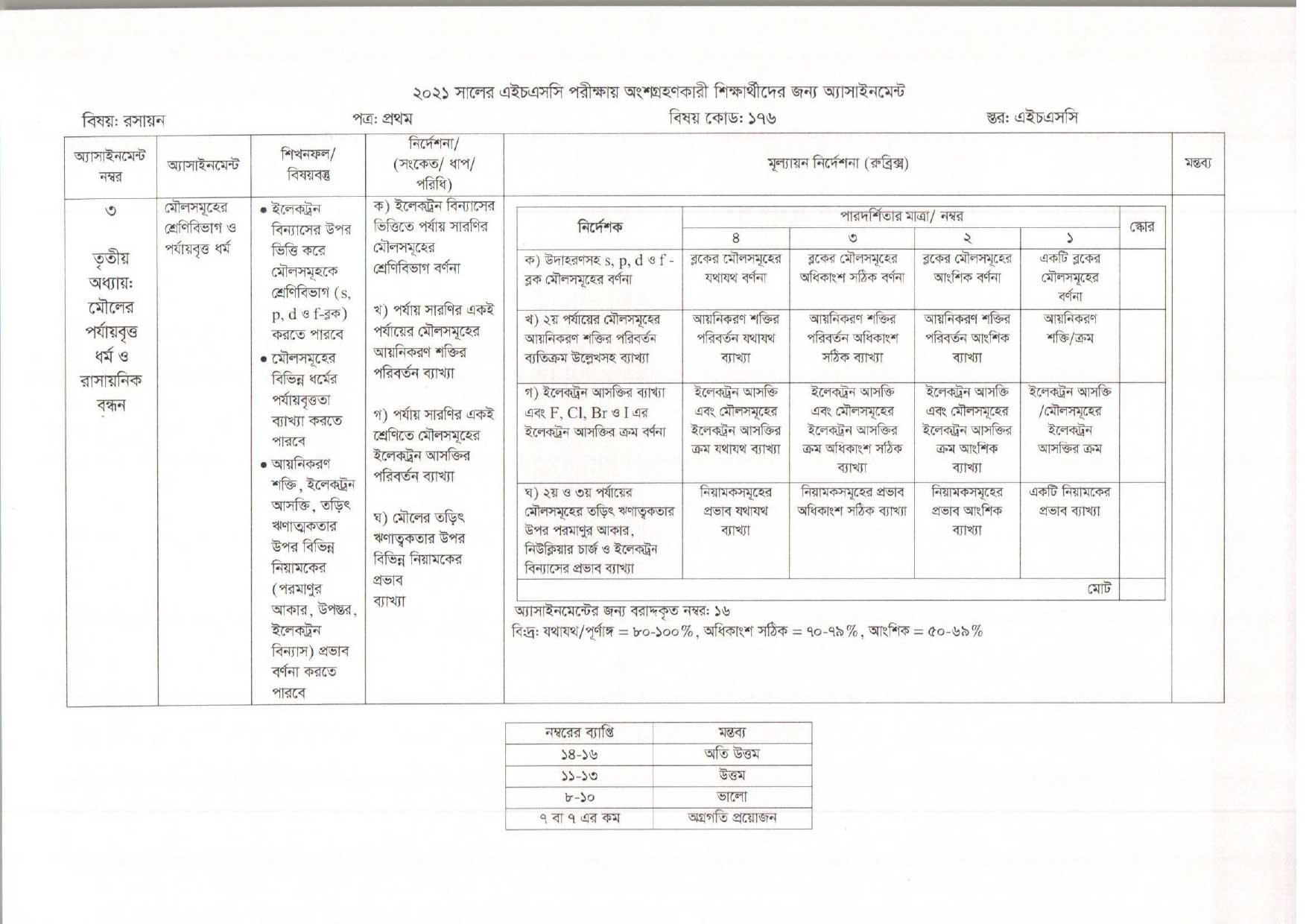
Assignment Answer:






HSC Chemistry Assignment 1st Week Answer (First Paper)
DSHE is published the First Week Chemistry 1st Paper Assignment Question from the 2nd Chapter (গুণগত রসায়ন ).
Check Now: HSC Biology Assignment Answer 2021 for the 1st and 2nd Paper for of weeks.
On the 26th of July, the Directorate of Secondary and Higher Education (DSHE) published the 1st Week Chemistry Assignment Question on dshe.gov.bd. Let’s take a look at the question and the solutions to the assignment.
Class: HSC 1st Year
Subject: Chemistry 1st Paper
Group: Science
Assignment Work:
পরমাণুর মডেল ও ইলেকট্রন বিন্যাস করতে হবে

Instruction for Writing the Assignment Answer
ক) পরমাণু মডেল বর্ণনা করা
খ) কোয়ান্টাম সংখ্যা সমূহ বর্ণনা করা
গ) কোয়ান্টাম সংখ্যা থেকে পরমাণুর বিভিন্ন শক্তিস্তরের ইলেকট্রন ধারণ ক্ষমতা নির্ণয় করা
ঘ) পরমাণুর উপশক্তিস্তরে ইলেকট্রন বিন্যাসের নীতি ব্যাখ্যা কর।
Assignment Answer:
ক) পরমাণু মডেল বর্ণনা করাঃ
বোর পরমাণু মডেল
রাদারফোর্ডের পরমাণু মডেলের ত্রুটি দিকে লক্ষ রেখে এবার ১৯১৩ খ্রিস্টাব্দে নিলস বোর কোয়ান্টাম তত্ত্বের উপর ভিত্তি করে একটি মডেল প্রদান করেন । এ মডেলকে বোর পরমাণু মডেল বলে। এ মডেলের তিনটি স্বীকার্য রয়েছে।
স্বীকার্যগুলো হলোঃ
১- শক্তিস্তর সম্পর্কিত ধারণাঃ পরমাণুর ইলেকট্রনগুলো নিউক্লিয়াসকে কেন্দ্র করে কতগুলো বৃত্তাকার কক্ষপথে ঘুরে। এ অনুমোদিত বৃত্তাকার কক্ষপথে গুলো কে প্রধান শক্তি স্তর বলে। শক্তিস্তরে ইলেকট্রনগুলো ঘূর্ণনের সময় কোন শক্তি শোষণ বা বিকিরণ করে না। প্রধান শক্তি স্তর কে n দ্বারা প্রকাশ করা হয়।
n= 1,2,3,4….
n=1 হলে, প্রধান শক্তিস্তর= K
n= 2 হলে, প্রধান শক্তিস্তর= L
n= 3 হলে, প্রধান শক্তিস্তর= M
n= 4 হলে, প্রধান শক্তিস্তর= N
কৌণিক ভরবেগ সম্পর্কিত ধারণাঃ একটি নির্দিষ্ট শক্তিস্তর ঘূর্ণায়মান ইলেকট্রনের কৌণিক ভরবেগ নির্দিষ্টএবং তা h/2(pi) এর গুণিতক।
সুতরাং, কৌণিক ভরবেগ, mvr= nh/2(pi)।
এখানে (m) =ইলেকট্রনের ভর
v= গতিবেগ
r=শক্তিস্তরের ব্যাসার্ধ
n= প্রধান শক্তিস্তর
h= (6.63*10-34 JS)
শক্তির বিকিরণ সম্পর্কিত ধারণাঃ বোর পরমাণুর মডেল অনুসারে ইলেকট্রন বিভিন্ন শক্তিস্তরের ঘূর্ণায়মান থাকার সময় কোন শক্তি শোষণ বা বিকিরণ করে না । কিন্তু ইলেকট্রন এক শক্তি থেকে অন্য শক্তিস্তরে যাওয়ার সময় শক্তি শোষণ বা বিকিরণ করে। এক্ষেত্রে ইলেকট্রন যদি নিম্নকক্ষপথ থেকে উচ্চকক্ষ পথে স্থানান্তরিত হয় তবে শক্তির শোষণ ঘটবে, আর যদি উচ্চ কক্ষ থেকে নিম্ন কক্ষপথে নেমে আসে তখন শক্তির বিকিরণ ঘটবে।
বোর পরমাণু মডেলেরও কিছু সীমাবদ্ধতা রয়েছে। এ মডেলের সীমাবদ্ধতা গুলো হল-
বোর পরমাণু মডেল যেসব পরমাণু বা আয়নে একটিমাত্র ইলেকট্রন আছে তাদের বর্ণালী ব্যাখ্যা করতে পারলেও একাধিক ইলেকট্রন বিশিষ্ট পরমাণুর বর্ণালী ব্যাখ্যা করতে পারে না।
এ মডেল অনুসারে একটি ইলেকট্রন এক শক্তিস্তর অন্য শক্তিস্তরের যাওয়ার সময় বর্ণালীতে একটি করে রেখে তৈরি হওয়ার কথা, কিন্তু বাস্তবে উচ্চশক্তিসম্পন্ন বর্ণালিবীক্ষণ যন্ত্রের সাহায্যে পরীক্ষা করলে দেখা যায়, প্রত্যেকটি রেখা আবার একাধিক সূক্ষরেখায় বিভক্ত হয়ে পড়ে। এ বিভক্ত হয়ে পড়ার ব্যাখ্যা বোরের মডেল দিতে পারেনি।
বোর পরমাণু মডেলের বলা হয়েছে ইলেকট্রনগুলো শুধু বৃত্তাকার কক্ষপথে ঘোরে। কিন্তু পরে প্রমাণিত হয় যে, ইলেকট্রন শুধু বৃত্তাকার কক্ষপথ নয়, উপবৃত্তাকার কক্ষপথেও ঘোরে।
এ মডেল আপেক্ষিকতা তত্ত্ব মেনে চলে না।
এবং এ মডেল এর সাহায্যে জিম্যান ও স্টার্ক ফলাফল বর্ণনা করা যায় না ।
রাদারফোর্ড পরমাণু মডেল
১৯১১ সালে বিজ্ঞানী আর্নেস্ট রাদারফোর্ড আলফা কণা বিচ্ছুরণ পরীক্ষা ওপর ভিত্তি করে পরমাণুর গঠন সম্পর্কে একটি মতবাদ প্রদান করেন। এই মতবাদ রাদারফোর্ড পরমাণু মডেল নামে পরিচিত। পরমাণুর কেন্দ্রস্থলের ধনাত্মক চার্জ বিশিষ্ট একটি ভারী বস্তু কন্যা বিদ্যমান। এ ভারী বস্তু কণাকে পরমাণুর কেন্দ্র বা নিউক্লিয়াস বলে।
- পরমাণুর মোট আয়তনের তুলনায় নিউক্লিয়াসের আয়তন অত্যন্ত ছোট। এবার একটু সহজে বুঝি, আমাদের দেহের মোট ওজনের তুলনায় দেহের প্রধান শ্বসন অঙ্গ ফুসফুসের ওজন কত ? অবশ্যই অত্যন্ত ছোট হবে। তেমনিভাবে পরমাণুর নিউক্লিয়াসের আয়তন পরমাণুর মোট আয়তনের তুলনায় অত্যন্ত ছোট।
- পরমাণু সামগ্রিকভাবেই চার্জ নিরপেক্ষ। অর্থাৎ পরমাণু সামগ্রিক চার্জশূণ্য। আমরা একটি বস্তুকণা কে কখন চার্জ নিরপেক্ষ বলতে পারি যখন ঐ বস্তু কণার মধ্যে সমানসংখ্যক ধনাত্মক ও ঋণাত্মক চার্জ বিদ্যমান থাকে। পরমাণুর ক্ষেত্রেও বিষয়টা একই। পরমাণুর নিউক্লিয়াসে যে কয়টি প্রোটন থাকে, নি নিউক্লিয়াস এর বাইরেও সে কয়টি ইলেকট্রন থাকে। আর প্রোটন হলো ধনাত্মক চার্জ বিশিষ্ট এবং ইলেকট্রন হলো ঋণাত্নক চার্জ বিশিষ্ট। যার ফলে সামগ্রীকভাবে পরমাণুর চার্জ শূণ্য হয়।
- সূর্যকে কেন্দ্র করে সৌরজগতের গ্রহগুলি যেমন ঘুরতে থাকে, তেমনি ঠিক একইভাবে পরমাণুর কেন্দ্রস্থলে অবস্থিত নিউক্লিয়াসকে কেন্দ্র করে পরমাণুর ইলেকট্রন গুলো ঘুরতে থাকে। যেহেতু পরমাণুর নিউক্লিয়াস কে কেন্দ্র করে ইলেকট্রনের ঘূর্ণন সৌরজগতের গ্রহ গুলোর সঙ্গে সাদৃশ্যপূর্ণ তাই এই মডেল কে সৌর মডেলও বলা হয়ে থাকে।
- ধনাত্মক চার্জ বিশিষ্ট নিউক্লিয়াস ও ঋণাত্মক চার্জবিশিষ্ট ইলেকট্রনের মধ্যে একটি স্থির বৈদ্যুতিক আকর্ষণ বল বিদ্যমান। আকর্ষণ বল ও ঘূর্ণনের ফলে তৈরি কেন্দ্রবিমুখী বল সমান। ফলে পরমাণু স্থিতিশীল হয়। কিভাবে। তোমার প্রশ্ন থাকতে পারে। আমরা জানি কোন একটি বস্তু কণা যখন বৃত্তাকার পথে ঘুরতে থাকে তখন বাইরের দিকে একটি বল কার্যকর হয়, যাকে কেন্দ্রবিমুখী বল বলে। এই বলটির কারণে বস্তুকণার ছিটকে বাইরে চলে যেতে চায়। সুতরাং বস্তুকণাটিকে যদি বৃত্তাকার পথে ঘুরতে হয়, তাহলে বস্তুকণাটির কেন্দ্রের দিকে সমান পরিমাণ বিপরীতমুখী বল ক্রিয়াশীল থাকতে হবে। এটিকে বলা হয় কেন্দ্রমুখী বল। অর্থাৎ বৃত্তাকার পথে ঘূর্ণায়মান বস্তুকণার কেন্দ্রমুখী বল ও কেন্দ্রবিমুখী বল সমান হলে একটি বৃত্তাকার পথে ঘুরতে পারবে। ঠিক তেমনিভাবে পরমাণুর ইলেকট্রন যদি নিউক্লিয়াস কে কেন্দ্র করে বৃত্তাকার পথে ঘুরতে চায় তবে এ কেন্দ্রমুখী ও কেন্দ্রবিমুখী বলের মান সমান হতে হবে। তা না হলে পরমাণুর ইলেকট্রন টি বৃত্তাকার কক্ষপথ থেকে বাইরে ছিটকে যেতে চাইবে। ফলে পরমাণুর অস্তিত্ব বজায় থাকত না।
সব কাজেরই কিছু না কিছু সীমাবদ্ধতা থাকে। তেমনি রাদারফোর্ডের পরমাণু মডেলেরও কিছু সীমাবদ্ধতা রয়েছে।
মডেলের সীমাবদ্ধতা
- এই মডেলের সাহায্যে পরমাণুর বর্ণালীর কোন ব্যাখ্যা পাওয়া যায় না
- এই মডেল ইলেকট্রনের কক্ষপথ এর আকার ও আকৃতি সম্পর্কে কোন ধারণা দেয়নি।
- রাদারফোর্ডের পরমাণু মডেল থেকে শুধু একটি ইলেকট্রন থেকে পরমাণু নিউক্লিয়াস কে কেন্দ্র করে ঘোরে, তা বর্ণনা করতে পারলেও একাধিক ইলেকট্রন কিভাবে পরমাণু কেন্দ্র করে ঘুরবে তা বর্ণনা করতে পারেনি।
- ইলেকট্রনের কৌণিক ভরবেগ সম্পর্কে কোন ধারণা দেয় নি।
- রাদারফোর্ডের পরমাণু মডেলে পরমাণুর নিউক্লিয়াসে ইলেকট্রন কে সৌরজগতের সূর্য ও গ্রহের সঙ্গে তুলনা করা হয়েছেকিন্তু সৌরজগতের সূর্য ও গ্রহ গুলো সাধারণত চার্জ নিরেপক্ষ। অন্যদিকে পরমাণুর নিউক্লিয়াস ও ইলেকট্রন চার্জযুক্ত। আই চার্জযুক্ত বস্তুর সংগে চার্জহীন বস্তুর সঙ্গে তুলনা করা ঠিক হয়নি।
খ) কোয়ান্টাম সংখ্যা সমূহের বর্ণনা
কোয়ান্টাম সংখ্যা পরমাণু তে অবস্থিত ইলেকট্রনের শক্তিস্তরের আকার-আকৃতি ত্রিমাত্রিক বিন্যাস প্রকরণ এবং অর্থনৈতিক প্রকাশক সংখ্যাসমূহকে কোয়ান্টাম সংখ্যা বলে।
কোয়ান্টাম সংখ্যা কে চার ভাগে ভাগ করা হয়েছে
- প্রধান কোয়ান্টাম সংখ্যা
- সহকারি কোয়ান্টাম সংখ্যা
- ম্যাগনেটিক কোয়ান্টাম সংখ্যা
- স্পিন কোয়ান্টাম সংখ্যা
প্রধান কোয়ান্টাম সংখ্যা – যে কোয়ান্টাম সংখ্যার সাহায্যে পরমাণু তে অবস্থিত ইলেকট্রন এর শক্তিস্তরের আকার নির্ণয় করা যায় তাকে প্রধান কোয়ান্টাম সংখ্যা বলে। প্রধান কোয়ান্টাম সংখ্যাকে n দ্বারা প্রকাশ করা হয়। যেমনঃ n= 1,2,3,4,5 ইত্যাদি।
সহকারি কোয়ান্টাম সংখ্যা- যে কোয়ান্টাম সংখ্যার সাহায্যে শক্তিস্তরের আকৃতি নির্ণয় করা যায় তাকে সহকারী কোয়ান্টাম সংখ্যা বলে। একে । দ্বারা প্রকাশ করা হয়, । = 0 ~ (n-1). সহকারী কোয়ান্টাম সংখ্যা প্রধান কোয়ান্টাম সংখ্যার উপর নির্ভরশীল।
ম্যাগনেটিক কোয়ান্টাম সংখ্যা – যে সকল সংখ্যার সাহায্যে ইলেকট্রনের কক্ষপথের ত্রিমাতৃক বিন্যাস দিক বিন্যাস প্রকরণসমূহ প্রকাশ করা হয় তাকে ম্যাগনেটিক কোয়ান্টাম সংখ্যা বলে। একে m দ্বারা প্রকাশ করা হয়। m= 0~ I
স্পিন কোয়ান্টাম সংখ্যা- নিজস্ব অক্ষের চারদিকে ইলেকট্রনের ঘুর্ননের দিক প্রকাশক সংখ্যাসমূহকে কোয়ান্টাম সংখ্যা বলে। একে S দ্বারা প্রকাশ করা হয় । s= + , –
গ) কোয়ান্টাম উপস্তরের শক্তিক্রম এবং আকৃতির বর্ণনা করতে পারবে।

ঘ) আউফবাউ, হুন্ড, পাউলির বর্জন নীতি প্রয়োগ করে পরমাণুর ইলেকট্রন বিন্যাস করতে পারবে।
আউফবাউ নীতিঃ
মৌলের পরমাণুতে ইলেকট্রন বন্টন এর ক্ষেত্রে কোন শক্তিস্তরের কোন অরবিটালে ইলেকট্রন আগে প্রবেশ করে তা যে নিয়ম অনুসারে হয়ে থাকে ঐ নিয়মটিকে বলা হয় আউফবাউ নীতি।
আউফবাউ একটি জার্মান শব্দ। এই শব্দের অর্থ হলো Building up বা নিচ থেকে উপরে তৈরির নিয়ম। অর্থাৎ একটি মৌলের পরমাণুতে ইলেকট্রন বিন্যাস গঠনের নিয়ম হচ্ছে Building up Principle বা আউফবাউ নিয়ম।
এই নিয়ম অনুসারে মৌলের পরমাণুতে শক্তির উচ্চক্রম অনুসারে অরবিটাল গুলোতে ইলেকট্রন প্রবেশ করে। অর্থাৎ নিম্ন শক্তির অরবিটালে ইলেকট্রন আগে প্রবেশ করবে। এই নিয়ম অনুসারে প্রধান ও সহকারী কোয়ান্টাম সংখ্যার সম্মিলনে (n+l) অরবিটালের শক্তি নির্ণীত হয়।
3dএবং 7s এর মধ্যে-
3d এর n=3,=2 n+=3+2=5
4s এর n=4, =0 n+=4+0=4
যেহেতু 4s এর ক্ষেত্রে n+ এর মান ছোট তাই এই অরবিটালে ইলেকট্রন আগে প্রবেশ করবে।
4p এবং 5s এর মধ্যে-
4p এর n=4,=1 n+=4+1=5
5s এর n=5, =0 n+=5+0=5
যেহেতু 4p এবং 5s এর উভয় ক্ষেত্রে n+ এর মান সমান তাই যে অরবিটালে n এর মান ঠোক সেই অরবিটালে ইলেকট্রন আগে প্রবেশ করবে। এজন্য 4p ইলেকট্রন দ্বারা আগে পূর্ণ হবে।
আউফবাউ নীতি অনুসরণের অরবিটালসমূহের শক্তির ক্রম-
1s <2s <2p<3s<3p<4s<3d<4p<4d<5p<6s<4f<5d<6p<7s<8s
হুন্ডের নিয়মঃ
অরবিটালে ইলেকট্রনের চুম্বক শক্তির মান এর উপর ভিত্তি করে সমশক্তি সম্পন্ন অরবিটালসমূহ ইলেকট্রন বিন্যাসের এর নিয়ম হুন্ড কর্তৃক প্রস্তাবিত হয়।
সমর শক্তি সম্পন্ন অরবিটালের ইলেকট্রন প্রথমে একটি করে একমুখী স্পিনে প্রবেশ করে অতঃপর প্রাপ্যতা অনুসারে অবশিষ্ট ইলেকট্রন বিপরীতমুখী প্রবেশ করে ।
অর্থাৎ সমশক্তিসম্পন্ন অরবিটালে ইলেকট্রন পারত পক্ষে জোড়ায় জোড়ায় প্রবেশ করে না। কারণ একই মুখী স্পিনের ইলেকট্রনদ্বয় পরস্পরকে বিকর্ষণ করে।
N- পরমাণুর ক্ষেত্রে হুন্ডের নীতি ব্যাখ্যা করা হলোঃ
N- এর সর্ববহিস্থ P উপস্তরে ৩টি ইলেকট্রন বিদ্যমান।
P উপস্তর আবার সমশক্তি সম্পন্ন 2Px, 2Py এবং 2Pz এই তিনটি অরবিটালে বিভক্ত। হুন্ডের নীতি অনুসারে বহিস্তরের ৩টি ইলেকট্রন প্রথমে একটি একটি করে একমুখী স্পিনে যথাক্রমে 2Px, 2Py এবং 2Pz অরবিটালে প্রবেশ করবে।
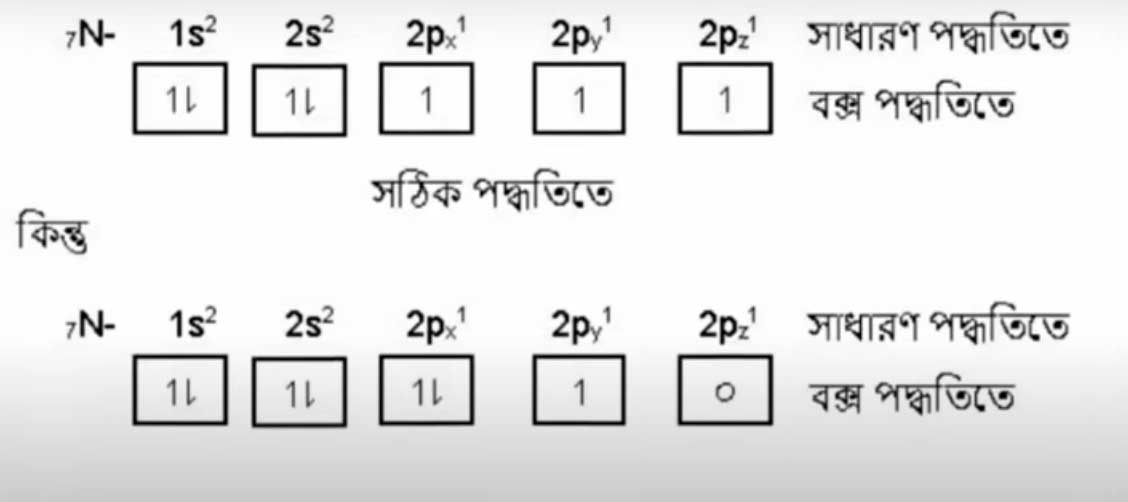
আবার O পরমাণুর ক্ষেত্রে দেখা যায়, উহার সর্ববহিস্থ p- উপাস্তরে ৪টি ইলেকট্রন বিদ্যমান। p উপস্তর আবার সমশক্তি সম্পন্ন 2px, 2py এবং 2pz অরবিটালে বিভক্ত।

হুন্ডের নীতি অনুসারে বহিস্তরের ৪টি ইলেকট্রন এর মধ্যে তিনটি ইলেকট্রন প্রথমে একটি একটি করে একমুখী স্পেনের যথাক্রমে 2px, 2py এবং 2pz অরবিটালে গমন করবে।

HSC Chemistry 2nd Paper Assignment Answer 2021
The question for the Chemistry second paper assignment for the HSC Exam 2021 has been published on dshe.gov.bd. As students are aware, the NCTB has Shorten the Chemistry second paper syllabus due to the COVID-19 Corona Virus.
The syllabus for the Chemistry 2nd Paper has been reduced to four chapters. These chapters are: First (পরিবেশ রসায়ন), Second (জৈব রসায়ণ), Third (পরিমাণগত রসায়ন and Fourth (তড়িৎ রসায়ন)।
Check Now: HSC Physics Assignment Answer 2021 for the 1st and 2nd Paper for of weeks.
The assignment question based on these chapters will be published by DSHE. In addition, they will publish the chemistry second paper assignment in these following weeks:
HSC 5th Week Chemistry Assignment Answer 2021 (2nd paper)
DSHE is published the HSC Chemistry 5th Week Assignment 2021 from the Second Chapter of the Main Chemistry Text Book.
They also published the assignment question, learning outcomes, writing instructions, and rubrics or assessment criteria online. Do you want to find out more? Simply read the article.
We have now prepared a sample Assignment Answer for the Chemistry 2nd paper in accordance with the guidelines provided by dshe.gov.bd. But first, let’s take a look at the assignment work, questions, solutions, and answers in the following sections.
Class: HSC 1st Year
Subject: Chemistry 2nd Paper
Group: Science
Week: 5th Week
Assignment Work: জৈব যৌগের বন্ধন বিভাজন এবং অ্যারোমেটিক যৌগের প্রস্তুতি ও প্রক্রিয়া আলোচনা করো

Assignment Answer:






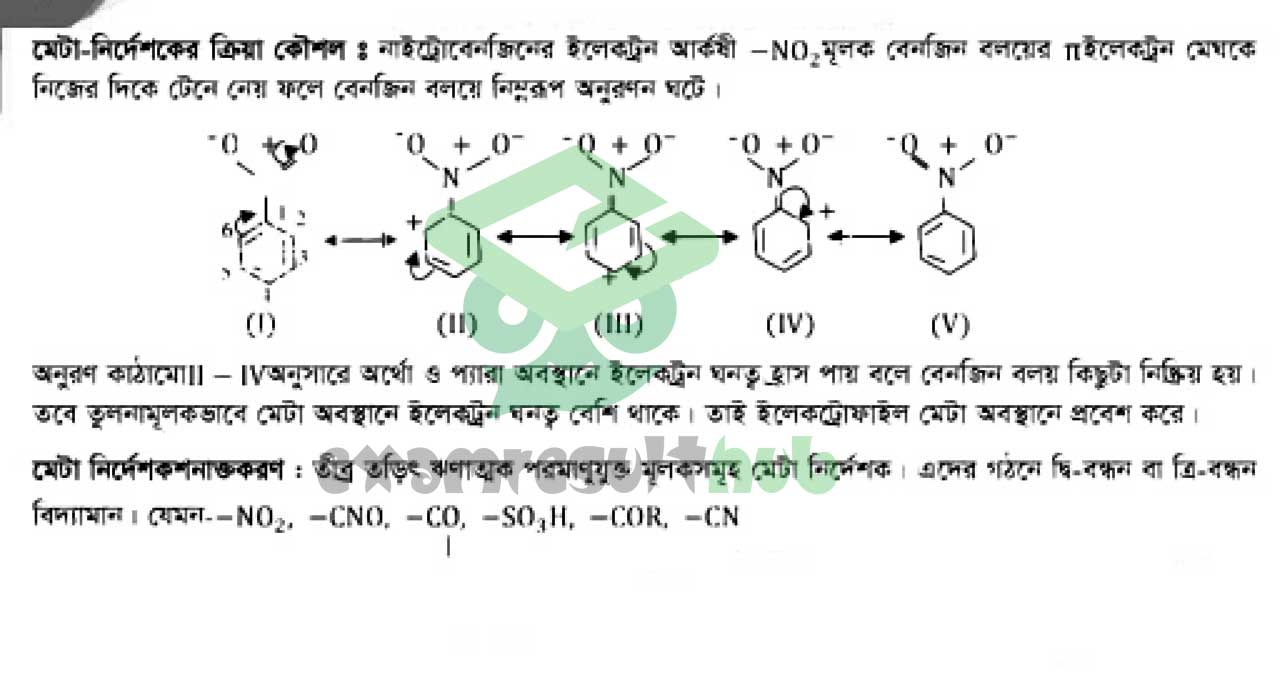
HSC Chemistry Assignment 2021 3rd Week Answer (Second Paper)
DSHE will publish the 3rd Week assignment question from the First chapter ( পরিবেশ রসায়ণ) of the Main textbook of Chemistry 2nd Paper Subject.
Class: HSC 1st Year
Subject: Chemistry 2nd Paper
Group: Science
Week: 3rd Week
Assignment Work:
গ্যাসের ধর্ম এবং আদর্শ ও বাস্তব গ্যাস
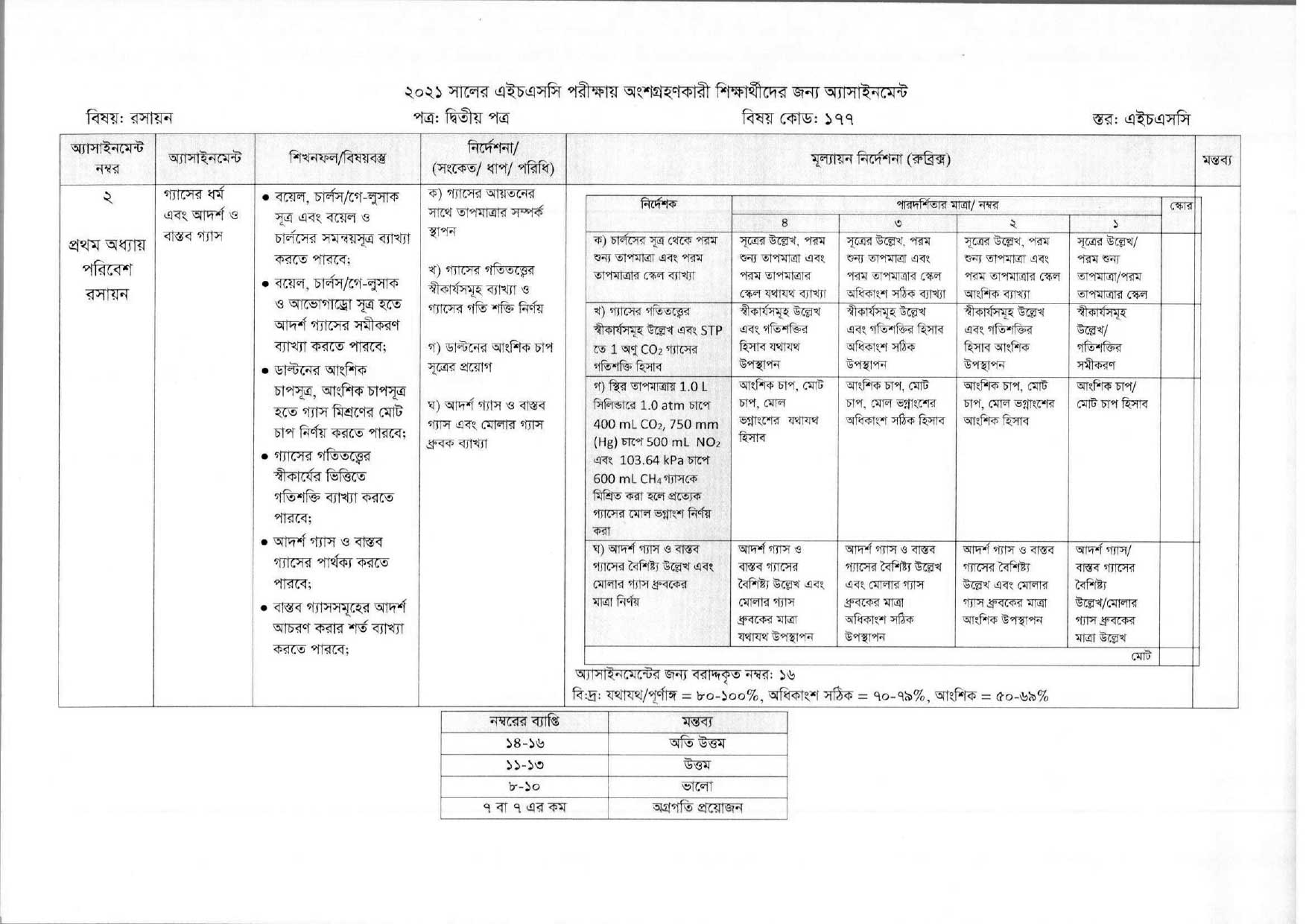
Instruction for Writing the Assignment Answer:
- গ্যাসের আয়তন এর সাথে তাপমাত্রার সম্পর্ক স্থাপন কর।
- গ্যাসের গতিতত্ত্বের স্বীকার্যসমূহ ব্যাখ্যা ও গ্যাসের গতিশক্তি নির্ণয় করা।
- ডাল্টনের আংশিক চাপ সূত্র প্রয়োগ দেখাও।
- আদর্শ গ্যাস, ও বাস্তব গ্যাস এবং মোলার গ্যাস ধ্রুবক ব্যাখ্যা করো।
Assignment Answer









How to create the HSC 2021 Chemistry Assignment to get Outstanding Remarks:
The HSC Exam 2021 Assignment will be composed of ten assignments, which will be worth 50 Marks. In addition, DSHE will include the results of the HSC Chemistry Assignment in the HSC Exam Result 2021.
As a result, students must participate in assignment work, collect Assignment Questions, and write assignment solutions before submitting them to colleges. Additionally, they must pay close attention to the following information to receive the highest possible Marks on the Assignment.
The rubrics or guidelines for grading each Assignment are made available once a week for reference purposes by the Directorate of Secondary and Higher Secondary Education.
It will help students achieve the highest possible score if they follow these guidelines when writing HSC Chemistry Assignment 2021 Solutions on their assignments.
Regardless of the situation, there are three important considerations for students to keep in mind when writing assignment solutions:
- Creativity,
- Consistency
- Accuracy.
Chemistry 5th week এর সমাধানটার ক), খ), গ), ও ঘ) হিসেবে আমাকে একটু চিহ্নিত করে দিন।
আমি 1st week থেকেই আপনার ওয়েবসাইট ভিজিট করে সমাধান করেছি। কিন্তু এই সাবজেক্ট টা বুজতে সমস্যা হচ্ছে। দয়া করে আমাকে সাহায্য করলে কৃতঞ্জ থাকিব।
The answer has been updated…